DESARRPOLLO PRENATAL
Fecundación o concepción. - La fecundación es el proceso de fusión de dos células haploides (espermatozoide y óvulo) para formar una nueva célula única.
• Etapa
embrionaria las células fertilizadas inician una serie impresionante de
transformaciones, esta etapa es la etapa embrionaria, que consta de cinco
subetapas: cigoto, mórula, blastocisto o blastocisto, gastrulación y embrión
• Huevos fertilizados. - Unas 22 horas después de la
fecundación, el óvulo fecundado sufrirá una serie de transiciones después de
formarse, gracias a un proceso llamado "segmentación" en el que el
óvulo fecundado se replica por mitosis, primero 2 células, luego 4, 8 células,
16. Cada una de estas células se denomina blastómero. Cuando se reúnen 16
blastómeros, el óvulo fertilizado se convierte en una mórula. La segmentación
tendrá lugar hasta que todas las células del embrión estén completas.
Morula. - Consta de 16 blastómeros que han dejado el
estado totipotente y se vuelven pluripotentes. Para el día 5, la mórula ingresa
a la cavidad uterina y se llena de líquido (H2O y Na), cuya presión forma una
cavidad: el blastocele. Por lo tanto, evoluciona hacia otra estructura llamada
blastocisto o blastocisto.
Gastrulación
El blastocisto entra en un proceso llamado
gastrulación, que comienza en la tercera semana (día 15) para formar la
gastrulación, que tendrá más de 64 células. Este proceso implica la
migración de las células formadas a diferentes zonas del blastocisto, formando
así tres tipos de tejido: un tejido externo (ectodermo), un tejido intermedio
(mesodermo) y otro tejido interno (endodermo).
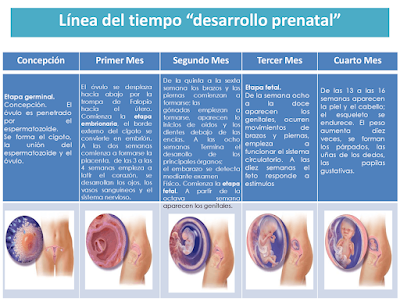
PERÍODO FETAL
Durante la vida fetal, no se forman nuevos órganos o tejidos, pero se produce la maduración y el desarrollo de los órganos o tejidos existentes. A continuación, se exponen los principales eventos de desarrollo durante las diferentes semanas del desarrollo fetal.
Desarrollo morfológico del sistema nervioso (SN)
A la finalización de la tercera semana; se forman los pliegues neurales, la mitad de la placa neural se hunde en el surco neural y los pliegues neurales ascienden gradualmente entre sí en la línea media, donde se fusionan. Esta fusión comienza en la región cervical (entre los somitas cuarto y quinto) y continúa craneal y caudalmente. Una vez completada la fusión, se forma el tubo neural neural y el ectodermo suprayacente
![]() Las crestas neurales
Las crestas neurales
Las crestas neurales dan origen a un grupo heterogéneo de tejidos, estos son:
- Tejido conectivo y óseo de la cara y el cráneo
- Ganglios de los nervios craneales.
- Célula C de la glándula tiroides
- Tabique tronconal del corazón.
- Dermis de la cara y el cuello.
- Raíces dorsales de los ganglios espinales.
- Cadena simpática y ganglios preaórticos.
- Médula suprarrenal.
- Ganglio parasimpático del tubo gastrointestinal.
- Células de Schwann. Células gliales
- Leptomeninges (aracnoides y piamadre)
- Melanocitos. Odontoblastos.
Bibliografía
Documentos de medicina - ciencias básicas. (2020). PROCESO
DEL DESARROLLO DE LA NEURULACION. Obtenido de
https://www.udocz.com/apuntes/239869/proceso-del-desarrollo-de-la-neurulacion
Olmedo, J. (2013). Período
fetal. Obtenido de
https://es.slideshare.net/joseolmedomd/perodo-fetal-24474218/
Valdés Valdés A, Pérez
Núñez HM, García Rodríguez RE, et al. Embriología humana. La Habana:
Ciencias Médicas; 2016: 45-54.
Saddler TW. Embriología Médica con
orientación clínica. 13a ed. España: Editorial Wolters Kluwer; 2016.
Moreno Castillo MA, Ramírez Cheyne J, Medina
Cárdenas S. Transición de epitelio-mesénquima y migración celular en células
de la cresta neural y células metastásicas de carcinomas. Univ Med
[Internet].2016[Citado 08/12/2018]; 57(1): 83-107. Disponible en: https://www.researchgate.net/publication/308964144_Transicion_epitelio-mesenquima_y_migracion_celular_en_celulas_de_la_cresta_neural_y_celulas_metastasicas_de_carcinomas_Revision_de_la_literatura
Carlson BM. Human Embryology and
Developmental Biology. Fifth Edition Chapter 12, 254-268. España: Editorial
Elsevier; 2014.
Pachajoa H,
Moreno F. Células de la cresta neural: Evolución, bases embrionarias y
desarrollo cráneo-facial. Revisión sistemática de la literatura. Rev
Estomatol Colombia [Internet]. 2015 [Citado 08/12/2018]; 23(2):45-56.
Disponible en: https://www.researchgate.net/publication/296702581_Celulas_de_la_cresta_neural_Evolucion_bases_embrionarias_y_desarrollo_craneo-facial_Revision_sistematica_de_la_literatura
Dupin E, Le Douarin NM. The neural crest, a
multifaceted structure of the vertebrates. Birth Defects Res C Embryo Today
2014;102(3):187- 209. Citado en PubMed;PMID:25219958.
Kalcheim C,
Kumar D. Cell fate decisions during neural crest ontogeny. Int J Dev Biol.
2017; 61(3-4-5): 195-203. Citado en PubMed;PMID: 28621417.
Jaroonwitchawan
T, Muangchan P, Noisa P. Inhibition of FGF signaling accelerates neural crest
cell differentiation of human pluripotent stem cells. Biochem
Biophys Res Commun [Internet]. 2016 [Citado 08/12/ 2018]; 481(1-2): 176-81.
Disponible en: https://www.clinicalkey.es/#!/content/medline/2-s2.0-27816457
Chiguala I,
Chuquimango P, Cieza A, et al. Malformación de cresta neural por
mutación del gen NF1 y su repercusión en el nivel de autoestima. Rev Méd
Trujillo [Internet].2017[Citado 08/12/ 2018];12(2):74-86. http://revistas.unitru.edu.pe/index.php/RMT/article/view/1548
Vega López GA, Cerrizuela S, Aybar M J.
Trunk neural crest cells: formation, migration and beyond. Int J Dev Biol
2017; 61(1-2):5-15.Citado en PubMed;PMID:28287247.
Ramos V, Roa
I. Células de la Cresta Neural y su
Relación con Cardiopatía Congénita: Revisión Sistemática de
la Literatura. Int J Morphol [Internet]. 2016 [Citado
02/10/2019]; 34(2): 489-94. Disponible en: https://scielo.conicyt.cl/pdf/ijmorphol/v34n2/art13.pdf
Skrypek N,
Goossens S, De Smedt E, et al. Epithelial- Mesencuimal- Trasition: Epigenetic
Reprograming Driving Cellular Plasticity. Trends in Genet. 2017; 33 (12):
943-59. Citado en PubMed;PMID:28919019.
Maguire LH, Thomas AR, Goldstein AM. Tumors
of the neural crest: Common themes in development and cancer. Dev Dyn. 2015;
244(3):311-22. Citado en PubMed;PMID:25382669.
Blaue C,
Kashef J, Franz CM. Cadherin-11 promotes neural crest cell spreading by
reducing intracellular tension-Mapping adhesion and
mechanics in neural crest explants by atomic force microscopy. Semin Cell Dev
Biol 2017;73:95-106. Citado en PubMed;PMID:28919310.
Dady A,
Duband JL. Cadherin interplay during neural crest segregation from the
non-neural ectoderm and neural tube in the early chick embryo. Dev Dyn 2017;
246(7): 550-65. Citado en PubMed;PMID:28474787.
Sánchez
Vásquez S. Control Epigenético- MicroARN de la Migración de las Células de la
Cresta Neural en Vertebrados [Internet]. [Tesis para optar el título
Profesional de Bióloga Genetista Biotecnóloga]. Lima, Perú[Citado
21//03/2019]; 2015. Disponible en: http://cybertesis.unmsm.edu.pe/bitstream/handle/cybertesis/4100/S%c3%a1nchez_ve.pdf?sequence=1&isAllowed=y
Martel B,
Figueroa Zelaya D. Aproximación clínico diagnostica de los síndromes
neurocutaneos más frecuentes. Rep Hisp Cienc Salud [Internet]. 2016 [Citado
20/02/ 2019]; 2(1): 71-80. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=5398764
Zhang D, Ighaniyan S, Stathopoulos L, et al.
The neural crest: a versatile organ system. Birth Defects Res. C Embryo
Today 2014; 102(3): 275-98. Citado en PubMed;PMID:25227568.





Comentarios
Publicar un comentario